Метаболическая коррекция неврологических нарушений коморбидного больного
1250
Вёрткин А.Л., Скотников А.С.
В практике любого врача, и особенно терапевта, ежедневно встречаются пациенты, у которых, несмотря на наличие той или иной соматической патологии, присутствуют различные неврологические симптомы, которые требуют подчас скорейшей консультации невролога с целью исключения острой неврологической патологии. Некоторые из подобных неотложных неврологических проблем больных терапевтического профиля рассмотрены ниже.
Одним из основных состояний, требующих немедленной консультации невролога в приемном отделении стационара, является гипертонический криз. В большинстве своем первой инстанцией, куда обращаются пациенты с гипертоническим кризом, является скорая медицинская помощь (СМП). Гипертонический криз является одной из самых частых причин вызова бригад СМП. По данным ННПОСМП, ежедневно в России осуществляется более 20 тыс. вызовов «03» по поводу гипертонического криза.
Анализ обращаемости пациентов с гипертоническим кризом за неотложной помощью в различных регионах показывает, что общая тенденция к возрастанию распространенности этой патологии наблюдается как в крупных мегаполисах, так и в небольших районных центрах. При этом увеличивается и количество неблагоприятных исходов, тяжелых осложнений. Только в Москве количество вызовов по поводу сосудистых кризов возросло за 3 последних года на 34%, а число госпитализированных пациентов увеличилось почти в 1,5 раза. Причиной высокой частоты вызовов бригад СМП в большинстве случаев является неадекватная терапия артериальной гипертензии. Так, 50–70% пациентов, обращавшихся по поводу гипертонического криза в СМП, принимают антигипертензивные препараты нерегулярно.
Наиболее опасен осложненный гипертонический криз, составляющий около 3% от всех неотложных состояний при артериальной гипертензии. Он характеризуется высокими цифрами артериального давления в сочетании с церебральной, кардиальной и вегетативной клиникой.
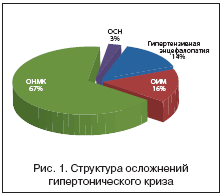
В структуре осложнений гипертонического криза гипертензивная энцефалопатия составляет 14%, инфаркт миокарда (ОИМ) – 16%, острое нарушение мозгового кровообращения (ОНМК) (в т.ч. транзиторная ишемическая атака) – 67%, острая сердечная недостаточность (ОСН) по типу отека легких – 3% (рис. 1).
Таким образом, цереброваскулярные осложнения гипертонического криза составляют 81% от их общего количества. В связи со значительной частотой развития, высокими показателями заболеваемости и смертности церебральный инсульт является в настоящее время актуальной медицинской и социальной проблемой. Сосудистые заболевания головного мозга вышли в России на второе место после кардиоваскулярных заболеваний среди всех причин смерти населения, при этом ишемические поражения головного мозга занимают доминирующее положение в структуре цереброваскулярной патологии, составляя до 80% всех сосудистых заболеваний.
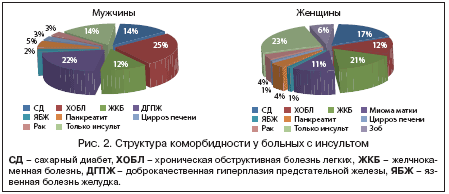
Церебральный инсульт в России ежегодно переносят более 450 тыс. человек [1]. Больные с инфарктом головного мозга имеют тяжелый коморбидный фон, в результате которого до 200 тыс. случаев инсульта заканчиваются летальным исходом, а из выживших пациентов до 80% остаются инвалидами разной степени тяжести. Структура коморбидности у данной категории больных представлена на рисунке 2.
Другой немаловажной проблемой, требующей от терапевта приемного отделения неотложного решения, является сочетание инфаркта головного мозга и ОИМ. Последний считается хорошо известной и важной причиной церебральной эмболии, которая является его первым симптомом. Именно эта тесная причинно–следственная связь двух сосудистых катастроф и вызывает у терапевта затруднения в отношении выбора превалирующей симптоматики в клинике болезни, а следовательно, и дальнейшей тактики профильной госпитализации и лечения больного. При ОИМ общемозговая симптоматика, включающая головокружение, неустойчивость при ходьбе, потемнение в глазах, слабость в конечностях, нередко превалирует в клинической картине. В ряде случаев возникают психические расстройства в виде возбуждения с двигательным беспокойством, нарушения сознания с дезориентацией в месте и времени. У части пациентов отмечаются очаговые симптомы в виде парезов, расстройств речи, гемианопсии, эпилептических припадков общего или фокального типа. Как правило, неврологические симптомы носят преходящий характер, однако у 10% больных очаговые симптомы бывают стойкими. С другой стороны, когда на первый план выступают мозговые явления, ОИМ протекает без присущих ему субъективных симптомов (боли, одышки, страха смерти) и без падения АД, что значительно затрудняет его диагностику. Для правильной постановки диагноза в этих случаях имеют значение данные анамнеза и электрокардиографического обследования.
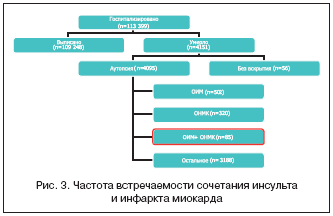
Авторами проанализировано 85 случаев сочетания инфаркта головного мозга и ОИМ у пациентов, умерших в многопрофильном стационаре скорой медицинской помощи в 2005–2007 гг. За это время в данный стационар поступило 113 399 больных с различной патологией. Удельный вес кардиоваскулярной патологии и сочетания ОИМ и инсульта представлен на рисунке 3.
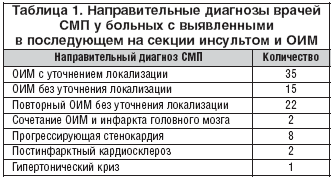
Средний возраст больных, умерших от данной сочетанной патологии, составил 67±12 лет. Все больные были госпитализированы службой СМП в приемное отделение с различными направительными диагнозами (табл. 1)
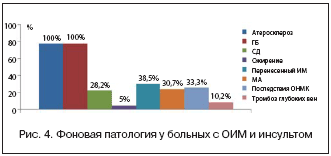
Эти больные имели отягощенный фон и огромный спектр сопутствующей патологии. Так, в 28,2% случаев фоном являлся сахарный диабет 2 типа, в 38,5% имелись последствия перенесенного инсульта, в 33,3% был постинфарктный кардиосклероз, в 30,7% случаев постоянная и в 10,4% – пароксизмальная форма мерцательной аритмии, а также другая сопутствующая патология (рис. 4).
Для диагностики инфаркта головного мозга 53 больным была выполнена компьютерная томография головного мозга, 56 пациентам произведена люмбальная пункция. Для диагностики ОИМ всем пациентам было проведено электрокардиографическое исследование, 14 больным – эхокардиография, 8 пациентам выполнен тропониновый тест, у 69 больных исследована фракция КФК [2].
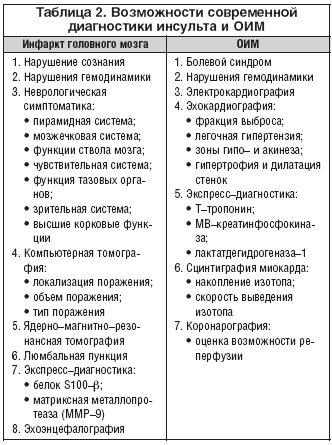
Современная медицина обладает достаточным количеством высокотехнологичных методик, позволяющих в короткие сроки диагностировать у подавляющего большинства пациентов как ОИМ, так и инфаркт головного мозга (табл. 2).
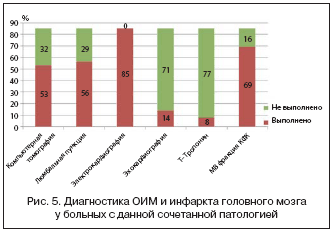
Как видно из рисунка 5, единый алгоритм тактики врачей–терапевтов в отношении диагностики и лечения данного сочетанного состояния отсутствовал, что отразилось в недостаточной прижизненной диагностике сочетания инсульта и инфаркта головного мозга (81% случаев).
Закономерно, что неполноценная диагностика приводит к последующим ошибкам в фармакотерапии, тем более что в лечении сочетания ОИМ и инсульта и без того существует ряд противоречий, например применение тромболизиса. Однако авторами получены данные, согласно которым безотлагательное проведение этой процедуры у пациентов с ишемическим инсультом и инфарктом миокарда приводит к значимой положительной динамике клинического течения как инфаркта головного мозга, так и ОИМ.
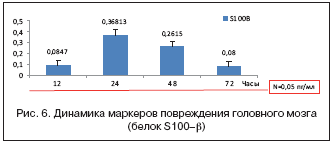
Следует упомянуть и о таком методе, как экспресс–диагностика ишемического инсульта за 72 ч от начала болезни: за это время претерпевают значительную динамику маркеры повреждения мозговой ткани, изучение которых может стать современным этапом диагностики инсульта (рис. 6).
Таким образом, несмотря на имеющиеся технические и лабораторные возможности, в стационаре скорой медицинской помощи и на догоспитальном этапе отсутствует соответствующая клиническим рекомендациям междисциплинарная методология оценки факторов риска, клинических проявлений, а также необходимых диагностических мероприятий и критериев прогноза сочетания ОИМ и инфаркта головного мозга [3]. Данные недоработки и недостаточное внимание к этой постоянно прогрессирующей проблеме приводят к неадекватной фармакотерапии и неблагоприятному прогнозу вышеназванных заболеваний.
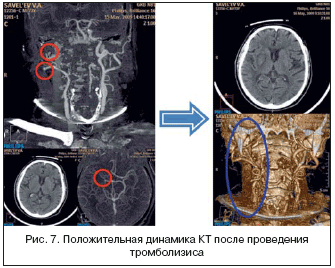
Клиническим примером успешно выполненного системного тромболизиса может служить больной С., 73 лет, поступивший по СМП в приемное отделение одного из крупных многопрофильных стационаров Москвы с диагнозом «ишемический инсульт». В связи с тяжелым состоянием жалоб пациент не предъявлял. Со слов врача СМП и сопровождающих больного родственников, состояние пациента ухудшилось остро: за несколько часов до госпитализации внезапно возникли слабость в левых конечностях и нарушение речи. Больной много лет страдает гипертонической болезнью, ишемической болезнью сердца, постоянной формой мерцательной аритмии, сахарным диабетом, хроническим обструктивным бронхитом.
На момент осмотра: уровень сознания – оглушение, вынужденный поворот головы и глазных яблок вправо, речь грубо дизартрична, асимметрия лица за счет сглаженности левой носогубной складки, девиация языка влево, симптом Маринеску–Родовича слева, левосторонняя гемиплегия со снижением мышечного тонуса и рефлексов, а также симптом Бабинского слева.
Компьютерная томография очагов измененной плотности в ткани мозга не выявила. Однако был диагностирован стеноз общей сонной артерии справа (60%), а также окклюзия ствола внутренней сонной артерии справа. Учитывая поступление больного в клинику в первые 3 ч после развития инсульта, наличие у больного выраженного неврологического дефицита и отсутствие противопоказаний, пациенту назначена процедура системного внутривенного тромболизиса тенектеплазой в дозе 0,5 мг/кг внутривенно капельно.
Однако, учитывая тяжелую коморбидность, консилиум вынес заключение, что процедуре тромболизиса должна предшествовать подготовка больного в виде введения корректора метаболизма, которым стал триметазидин.
Суммарная доза тенектеплазы составила 40 мг. Около 10% препарата введено внутривенно болюсно в течение минуты, а оставшаяся доза 36 мг – внутривенно капельно в течение 30 мин. Во время тромболитической терапии осуществлялся контроль жизненно важных показателей и неврологического статуса по шкале NIHSS. Уровень артериального давления находился в пределах 170–140/80–90 мм рт.ст. Дыхание самостоятельное, частота дыхания – 17–20 в мин., p[O2] – 95–97%, ЧСС – 70–80 уд./мин.
Через 15 мин. после начала процедуры у пациента появились движения в левой ноге. Через 1 ч отмечались регресс общемозговой симптоматики, установка головы и глазных яблок по центру, появился мышечный тонус в левой руке, тыльные сгибательные движения в пальцах левой кисти, наросла мышечная сила в правых конечностях, уменьшилась степень выраженности дизартрии. На контрольной компьютерной томографии очагов измененной плотности в ткани мозга не появилось. Восстановлена проходимость общей и внутренней сонной артерий справа.
Сужение ствола внутренней сонной артерии справа уменьшилось с 60 до 15%. По завершении тромболитической терапии было принято решение продолжать терапию триметазидином (рис. 7).
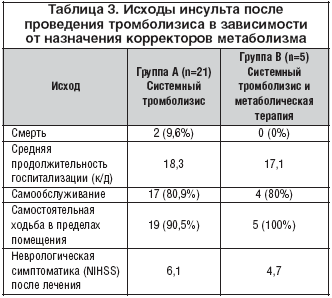
Первый опыт системного тромболизиса с предшествующей терапией корректорами метаболизма был получен весной 2011 г. – данная терапия была назначена 5 коморбидным больным ишемическим инсультом. Исходы данных больных несколько отличались от пациентов, которым терапия триметазидином не предшествовала проведению тромболизиса (табл. 3)
Как видно из таблицы 4, в группе корректоров метаболизма не было зафиксировано ни одного летального исхода, а средняя продолжительность госпитализации была ниже, чем у пациентов, которым терапия корректорами метаболизма не проводилась.
Таким образом, согласно первым полученным нами данным, пожилым коморбидным пациентам с ишемическим инсультом перед процедурой тромболизиса тенектеплазой целесообразно назначение метаболической терапии, что улучшает естественное течение основного заболевания и его исходы, а также способствует благоприятному прогнозу больных и их скорейшей реабилитации.
Следующими неотложными неврологическими ситуациями, с которыми ежедневно сталкивается врач– терапевт приемного отделения стационара, являются состояния, ассоциированные с приемом алкоголя и его суррогатов. К неотложным состояниям, ассоциированным со злоупотреблением алкоголем, со стороны ЦНС относятся:
• Острое отравление этанолом – острое заболевание, проявляющееся в угнетении функций ЦНС, пропорциональном концентрации алкоголя в крови. Термин является самостоятельной нозологией и имеет шифр и код в МКБ–10.
• Алкогольный абстинентный синдром – патологическое состояние, вызванное острым лишением (отнятием) алкоголя у лица с алкогольной зависимостью. Термин является самостоятельной нозологией и имеет шифр и код в МКБ–10.
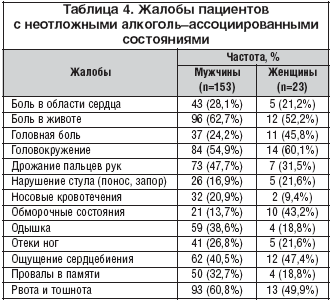
Подавляющая часть пациентов с алкоголь–ассоциированной патологией предъявляет неспецифические жалобы, среди которых немалый процент занимает и неврологическая симптоматика. Именно эти жалобы зачастую вносят путаницу в тактику ведения этих больных и являются причиной их непрофильной госпитализации. Авторами были проанализированы подобные жалобы у 176 пациентов (табл. 4).
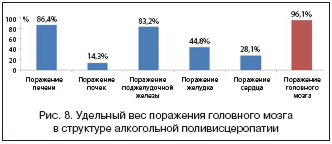
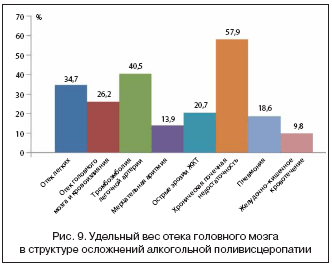
Алкогольная поливисцеропатия, как правило, имеющаяся у пациентов с хронической алкогольной интоксикацией, приводит к полиорганной недостаточности, которая нередко и становится и причиной, и фоном для развития неотложных состояний и летального исхода. Авторами была проанализирована структура алкогольной поливисцеропатии и удельный вес поражения головного мозга при ней (рис. 8).
Таким образом, при алкогольной поливисцеропатии поражение печени имеет место в 86,4% случаев, поражение сердца – в 28,1%, поражение почек – в 14,3%, поражение поджелудочной железы – в 83,2%, поражение желудка – в 44,8%, а поражение головного мозга – в 96,1% случаев, т.е. практически у каждого больного [4].
Морфологическим отражением алкогольного поражения головного мозга является его отек, который обнаруживается на вскрытии у трети скончавшихся пациентов с хронической алкогольной интоксикацией и у всех больных, умерших от острого отравления этанолом или во время алкогольного абстинентного синдрома (рис. 9).
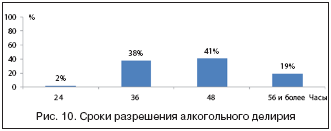
Именно отек головного мозга приводит к развитию делирия при остром отравлении этанолом и алкогольном абстинентном синдроме, который, по нашим данным, развивается у 16–18% пациентов и приводит к летальному исходу примерно в четверти случаев. Сроки разрешения алкогольного делирия различаются в каждом конкретном случае, составляя в среднем 46–50 ч (рис. 10).
Кроме того, прием алкоголя может повлечь за собой развитие комы – наиболее значительного патологического торможения центральной нервной системы с глубокой потерей сознания, отсутствием рефлексов на внешние раздражители и расстройством регуляции жизненно важных функций организма.
Угнетение сознания и ослабление рефлексов (черепных нервов, сухожильных, периостальных, кожных) прогрессируют до полного угасания по мере углубления комы. Первыми угасают наиболее молодые, последними – наиболее старые рефлексы. При отсутствии очаговых поражений головного мозга углубление комы сопровождается появлением, а в дальнейшем – утратой двусторонних патологических знаков (рефлекс Бабинского). Для очаговых поражений свойственна их односторонность. При отеке мозга и раздражении мозговых оболочек появляются менингеальные знаки, такие как ригидность затылочных мышц, симптомы Кернига и Брудзинского.
Прогрессирование церебральной недостаточности с угасанием функций центральной нервной системы приводит к различным нарушениям дыхания с гипо– или гипервентиляцией и соответствующими респираторными сдвигами кислотно–основного состояния. Грубые нарушения гемодинамики обычно присоединяются в терминальном состоянии. Другие клинические проявления, темп развития комы, данные анамнеза обычно достаточно специфичны при разных вариантах этого состояния (алкогольная, гипертермическая, гипергликемическая, гипогликемическая, гипокортикоидная, травматическая, эклампсическая).
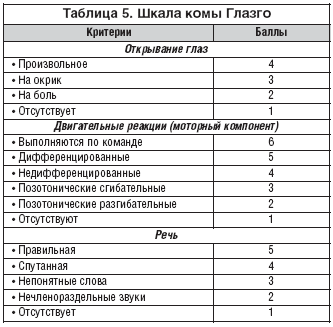
В таблице 5 представлена шкала комы Глазго, по которой врачом–терапевтом может быть оценена степень нарушения сознания при коме. По этой шкале производится оценка трех показателей: речевой продукции, реакции на боль и открывания глаз. Оценку каждого типа ответа выполняют независимо от других. Сумма трех ответов определяет глубину расстройств сознания. Уровень комы может варьировать от 3 (атоническая кома) до 15 (ясное сознание) баллов.
Одним из основных алкоголь–ассоциированных заболеваний является алкогольная кардиомиопатия. Стандартное лечение сердечной недостаточности при алкогольной кардиомиопатии мало отличается от лечения недостаточности кровообращения другой этиологии. Коррекция метаболических нарушений является патогенетически обоснованным методом лечения алкогольной кардиомиопатии как заболевания, развившегося именно вследствие патологических процессов в структуре кардиомиоцитов. Попытки коррекции этих нарушений ранее предпринимались неоднократно (витаминотерапия, преимущественно витамины группы В; рибоксин; АТФ), но достоверных данных, подтверждающих эффективность этой терапии, не получено. Однако следует знать, что существуют две принципиально различные формы данной коррекции, а именно:
• метаболическая терапия (лечение метаболитами);
• коррекция метаболизма (лечение ингибиторами или активаторами ферментов).
Корректоры метаболизма, не являясь субстратами биохимических реакций, угнетают гиперактивные ферменты или восстанавливают активность блокированных ферментов. Поэтому нормализация гомеостаза осуществима относительно малыми дозами корректоров метаболизма, и такая терапия отличается высокой эффективностью.
Хорошо известно, что ишемия миокарда приводит к активизации перекисного окисления липидов с образованием свободных радикалов, которые в свою очередь, оказывают повреждающее действие на кардиомиоцит. Лечение сердечно–сосудистых заболеваний зачастую основывается на «трех китах» – нейрогуморальной блокаде, гемодинамической поддержке и коррекции метаболизма, которая относится к вспомогательной терапии. Именно в качестве адъювантной терапии при кардиомиопатиях наиболее часто используются триметазидин, рибоксин, кокарбоксилаза, АТФ, панангин [5]. Триметазидин относится к современной группе лекарственных средств, влияющих на парциальное окисление свободных жирных кислот – p–FOX ингибитором. Эффективность применения триметазидина в отношении перекисного окисления липидов, липидного состава крови, маркеров воспаления миокарда в настоящее время достаточно широко подтверждена рядом клинических исследований. Полученные исследователями данные говорят о том, что триметазидин достоверно снижает в крови продукты перекисного окисления липидов за счет активации защитных антиоксидантных ферментов.
Таким образом, наличие неврологической клиники у пациентов терапевтического и кардиологического профиля должно являться поводом для одновременного совместного осмотра больного несколькими специалистами, а также повышенного внимания к данному пациенту и проведения разностороннего обследования с целью назначения рациональной, адекватной и современной комплексной фармакотерапии основного заболевания с участием корректоров метаболизма.
Первым российским дженерическим препаратом триметазидина является Тримектал® МВ производства компании «Вертекс». Тримектал® МВ полностью биоэквивалентен оригинальному триметазидину и хорошо изучен, в том числе у пациентов с цереброваскулярными заболеваниями [6]. Применение качественного дженерика может увеличить число пациентов, принимаюших триметазидин, что способствует своевременной коррекции заболеваний у пациентов кардиологического и неврологического профиля.
Литература
1. Отчет национальной ассоциации по борьбе с инсультом, 2008.
2. Вёрткин А.Л., Кульниченко Т.В., Аристархова О.Ю. и др. Острый коронарный синдром: место бета–адреноблокаторов // Лечащий врач. – 2008. – № 6. – С. 66–70.
3. Вёрткин А.Л., Зайратьянц О.В., Вовк Е.И. Окончательный диагноз. – М.: ГЭОТАР, 2008.
4. Вёрткин А.Л., Скотников А.С., Тихоновская Е.Ю., Скворцова А.А. Особенности клинического течения и фармакотерапии алкогольной болезни печени, сердца и головного мозга у больных с соматической патологией // Лечащий врач. – 2009. – № 7. – С. 64–69.
5. Гордеев И.Г., Бекчиу Е.А., Люсов В.А. Оценка влияния миокардиальных цитопротекторов на процессы перекисного окисления липидов у больных со стабильной стенокардией до и после хирургической реваскуляризации миокарда // Рос. кардиол. журнал. – 2005. – № 3.
6. Клочева Е.Г., Фомина Е.Б., Комяхов А.В. Применение Тримектала в терапии хронической недостаточности мозгового кровообращения // РМЖ. – 2009. – №11.
Ключевые слова статьи: больного, коррекция, нарушений, неврологических, Метаболическая